
器官芯片(Organs-on-a-chip, OOCs)是指体外建立的微型组织和器官,可以模拟人体生理或病理状态。器官芯片集成了组织工程学、半导体制造以及不同来源的人体细胞培养等领域的新进展。结合人类干细胞技术,器官芯片有望更好的模拟在体病理生理状态,弥补现有细胞和动物模型的不足。鉴于器官芯片具有良好的应用前景,哥伦比亚大学生物医学工程系和医学系的Kacey Ronaldson-Bouchard教授及Gordana Vunjak-Novakovic教授共同撰写了本篇综述,概述了单器官芯片和多器官复合芯片的设计理念,探讨了目前所面临的挑战,并阐述了器官芯片在药物研发和精准医疗中的潜在价值和应用前景。本篇综述文章于2018年3月发表于《Cell Stem Cell》杂志上。

由于人体是一个由多器官共同组成的高度复杂且精细的系统,体外模拟人体生理或病理状态是一项艰巨的任务,但其对于转化医学研究和人类健康而言十分重要。目前的生物医学研究主要依赖于体外培养的人体细胞或啮齿类动物模型。体外细胞培养可以直接反映药物的部分药理学效应,但由于这一简化模型的生理学功能与人体真实情况存在显著差异,其预测效力是有限的。与之相比,动物模型能够模拟特定器官或多器官水平的功能,但其局限性在于动物和人体生理之间的固有差异,这使得基础研究向临床转化的过程中遇到阻碍。器官芯片结合上述模型的优点,在组织特异性的三维环境中培养人体细胞,构建与人体相似的组织细胞结构和细胞外环境,重建特定器官在人体内的结构与生理功能。
器官芯片的目的并不是建立一个完整的活体器官,而是建立一个模拟人体生理状态的可控最小功能单元。例如,将细胞培养于特定的基底膜上可以建立不同组织细胞的界面模型,如肺-毛细血管界面和血脑屏障,同时多细胞共培养体系有助于细胞间的相互作用。对于大多数人体组织而言,器官芯片还需整合物理学因素,比如流体力学、机械力学和电学特征等,这对于器官的发育成熟和功能十分有必要,有助于得出更具生理意义的研究结果。采用具有体积比和流量分布的微流控装置连接单器官芯片可以进行多器官整合,模拟人体生理状态,建立人体体外模型的子系统。
一、器官芯片的现实意义
采用器官芯片可以获得人类遗传学、生理学、病理学等方面的多样性资料,从而降低药物研发的风险并推动个体化治疗。2003年,科学家首次尝试将细胞培养与微流控技术进行整合,构建出器官芯片的雏形。现阶段的器官芯片平台运用微流控技术和三位细胞培养构建微米级的人体组织和器官,减少了动物模型、细胞培养和临床研究之间的安全性和有效性的差异,从而加速药物研发。临床研究耗资巨大且极具风险性,许多药物在临床阶段的试验无效,而通过人体器官芯片模型获得的大量数据可以改变这一现状。采用病人特异性的细胞建立的模型可考虑到个体基因多样性、种族、性别及年龄等因素的差异,而不是将病人作为一个群体来诊治。同样,精准医疗有助于不能纳入标准临床试验设计的病人群体(比如罕见病和儿科疾病)的体外临床试验,或根据患者特定生理状态优化药物治疗方案。此外,器官芯片符合减少、优化和替代动物模型的3R原则,为研究者们提供了更符合伦理的选择。
二、器官芯片的设计理念
器官芯片是将培养细胞组装成为具备人体器官功能的三维组织结构。器官芯片结合传统的人体细胞培养的便捷性和器官系统的高生物保真度,采用简单的方法构建能够预测器官水平的功能单位。为了实现这一目标,器官芯片利用了微流控体系的控制策略和多参数方法的优势。由于微加工方法最初用于电子产业研发芯片,因此器官芯片中“芯片”由此得名。在设计器官芯片的过程中,第一步是确定器官模型的功能特征,参数表征以及解答科学问题的数据。同时也应明确器官芯片的复杂度,考虑与药物筛选方式的兼容性以及实用性。器官芯片可用于量效关系研究,从而确定合适的药物剂量使用方案。
三、单个器官芯片
器官芯片的设计原则基于模拟器官系统的生理学特征。理想情况下,器官系统的最小功能单元可以用于构建器官芯片环境。建立的器官芯片模型应整合生物物理刺激以及最低限度的功能性。
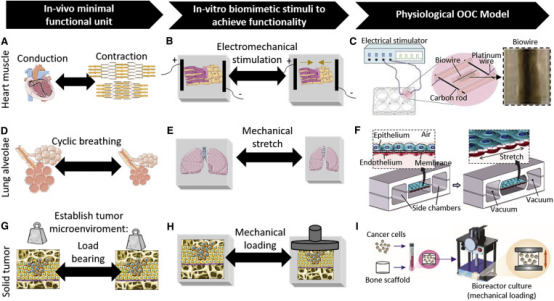
图1:器官芯片设计
(A-C)心脏器官芯片设计:模拟心肌传导和收缩(A),体外给予电刺激和机械刺激(B),心脏生物电线器官芯片设计;
(D-F)肺芯片设计:通过给予机械性牵拉力模拟体内周期性呼吸过程(D-E),肺芯片组成包括多孔膜两侧的肺上皮细胞和内皮细胞,同时给予机械牵张力(F);
(G-I)实体肿瘤器官芯片:模拟肿瘤微环境(G),引入机械作用力促进模型功能成熟(H),肿瘤器官芯片示例(I)
●心脏芯片
在来自心脏传导系统的兴奋性电信号作用下,心脏通过收缩泵血。因此,具有收缩功能的心肌纤维束可以作为心肌的最小功能单元,同时其可以在去极化电信号的作用下收缩和产生作用力。电刺激模拟窦房结的起搏功能,电信号作用下细胞同步性收缩组成心脏器官芯片模型的主要部分。心脏器官芯片设计原则包括,人诱导性多能干细胞来源的心肌细胞(hiPS-CMs)各向异性排列,包含支持细胞(成纤维细胞和内皮细胞),电机械刺激,以及心脏收缩性和电生理的实时监测。由于心脏器官芯片受到iPS-CMs未成熟表型的限制,尚需更优的成熟方案推进这一模型建立。近来有研究发现,采用新的方法形成高度排列的心肌组织(生物电线),并且通过电刺激使得这些微型组织成熟并具备功能特征。通过使得水凝胶内的心肌细胞进行周期性收缩实现机械刺激同样可以促进模型功能成熟。电刺激和机械刺激可以相互结合共同促进模型成熟,产生生理性药物反应。流体灌注增强心脏器官芯片的功能,同时可以通过生物打印排列规则的内皮细胞和心肌细胞实现血管结构的整合。
●肺芯片
当空气进入肺部后,肺泡上皮的机械伸展活动发生周期性变化,使得气体交换有效面积增大。将肺泡作为肺部最小功能单元,肺泡区域的血管内皮细胞和肺上皮细胞仅由一层基底膜分隔开,研究者可以通过在气体交换界面引入机械牵拉力模拟周期性舒缩变化。多孔膜的一侧接种人肺泡上皮细胞,并与气体接触,多孔膜的另一侧接种血管内皮细胞,给予血管灌注。同时芯片中加入机械牵拉力作用于多孔膜,模拟肺泡上皮的呼吸运动情况。采用数学模型优化肺芯片的液体流动,使得肺泡毛细血管界面气体和液体通道内的气体浓度可控,同时可以检测两个腔室内气体交换变化。
●肝芯片
肝脏具有许多重要的生理功能,包括药物和毒性物质的代谢,糖原储存以及血浆蛋白合成。肝脏的最小功能单元是肝小叶或肝血窦,其中有参与药物代谢的肝细胞。随着体外培养时间延长,肝细胞的功能逐渐降低,当肝细胞与成纤维细胞或其他支持细胞共培养,或者进行灌流培养可以改善肝细胞的功能。肝血窦器官芯片中将致密排列的肝细胞和内皮屏障整合在一起。肝脏器官芯片模型主要采用原代人肝细胞,其寿命和来源有限,而细胞系的功能特征不完善。采用诱导性多能干细胞分化得到的肝细胞构建肝脏器官芯片是未来发展的方向,并且有助于个体化治疗。
●肾芯片
肾脏具备滤过和重吸收功能,其最小功能单元是肾单位,包括肾小球,近曲小管,髓袢等结构。肾脏器官芯片包含多种细胞类型,在三个不同腔室中发挥功能性肾小球滤过功能,近曲小管重吸收以及髓袢尿液浓缩功能。在含有原代细胞的近曲小管器官芯片中引入液体流动促进其功能成熟,并且可以表现出在体的病理生理变化以及药物毒性反应。微流控系统也可以用于模拟药物转运机制以及其毒性效应。
●肠芯片
肠道器官芯片可以模拟口服药物的吸收、代谢以及转运。肠道器官芯片模拟肠上皮的绒毛和微绒毛结构提供较大的表面积,同时引入肠道共生菌,周期性的牵张力模拟肠道蠕动状态。对基于多孔膜的肠道芯片进行改进,采用三维结构促进绒毛结构形成,同时模拟肠上皮顶部和基底部。其他的肠道器官芯片采用蠕动和液体流动诱导人Caco-2细胞形成小肠绒毛,并实现其功能性。采用诱导性多能干细胞建立肠道模型的方法包括肠道类器官,利用细胞三维自主装,分化和形态生成的固有特性。
●血脑屏障芯片
器官芯片模拟血脑屏障的功能,可以测试用于治疗神经系统疾病的药物是否可以通过血脑屏障,并作用于靶点。现有模型将内皮细胞培养于基底膜一侧,并在另一侧培养星形胶质细胞和/或周细胞。采用跨内皮阻抗作为功能性指标,微流控系统的灌流可以增加屏障功能,并可以更好预测药效。神经血管单元器官芯片通过多孔膜将血管化腔室和大脑腔室进行整合,旨在于建立更具说服力的血脑屏障模型。除了模拟血脑屏障外,大脑模型同样具有重要意义,诱导性多能干细胞神经外胚层组织得到的3D人脑器官对于体外大脑模型有着重要意义。
●血管芯片
血管对于运输营养物质和代谢产物十分重要,同时作为血液循环药物的选择性屏障。血管芯片的构建方式包括,将内皮细胞接种在支持结构上(比如模具,3D打印以及采用模具作为血管网络)或者将细胞与水凝胶重悬然后在通道之间诱导出芽。将间充质干细胞与胶原混合,然后在侧壁接种内皮细胞,灌流一周可以促进血管结构的成熟,对血管活性药物产生反应性,从而构成人组织工程化血管。微血管网络形成方式包括,将内皮细胞和成纤维细胞与纤维蛋白凝胶重悬,然后在侧通道内引入机械因素(流体和压力)和化学因素(VEGF,低氧和营养剥夺)诱导血管出芽,最终形成可灌注的血管网络。●肿瘤芯片抗肿瘤药物研发主要采用动物模型,特别是小鼠模型,可以用于探讨基因在疾病中的作用,并建立疾病表型的动物模型。但是,这些研究在临床转化过程中遇到阻碍。肿瘤器官芯片模型可以作为系统性体外工具研究肿瘤。器官芯片可以测试药效,模拟肿瘤转移并建立个体化肿瘤模型。肿瘤器官芯片重塑肿瘤发生、发展的微环境(比如骨肉瘤或乳腺癌转移的骨微环境),使得所建立的模型与人体更加接近,模拟肿瘤的表型,发生发展过程以及与周围组织的相互作用。例如,将骨肉瘤细胞培养于骨微环境中,然后在形成的微肿瘤中加入机械刺激,共同构建骨肿瘤器官芯片模型。并且,在3D模型中模拟骨的机械信号,可以恢复ERK1/2-RUNX2信号通路,参与肿瘤耐药。采用病人来源的骨肉瘤模型可以解释临床上酪氨酸激酶受体抑制剂疗效不佳的原因。因此,肿瘤器官芯片有助于深入探讨机械生物因素与肿瘤耐药之间的关系。同时在肿瘤器官芯片中引入血管结构,可以预测肿瘤的转移情况。理想情况下,血管结构可以为肿瘤提供营养,同时也存在类似于体内的低氧区域,促进肿瘤细胞转移到周围转移以及肿瘤转移。比如,血管化的神经母细胞瘤可以模拟血管生成以及耐药,并提示SOX2参与的耐药机制。
四、复合器官芯片的整合

图2:整合多器官芯片形成人体芯片
(A-C)整合多器官芯片体系的方法:静态培养(A),单向灌流(B),再循环灌流体系(C)
(D)单个器官芯片相互连接示意图
细胞和器官通过分泌可溶性因子和细胞外囊泡等与外周循环系统建立联系。采用微流控系统将不同的器官芯片相互连接起来,模拟体内血流灌流,并可以对培养环境进行调控。这些连接可以实现不同器官之间的相互联系,更接近生理状态,有助于探讨药物的转运和摄取。整合的方式包括静态腔室,单向灌流或者再循环微流控灌流。
对于静态的器官腔室,器官之间的连接依赖于邻近腔室的物理距离,而不是流体连接。将细胞和器官培养在同一个腔室中有助于可溶性因子转运以及细胞间相互交流。共培养模型还可以采用同样的培养基整合多器官系统。为了建立口服生物利用度的模型,将人Caco-2细胞培养在Transwell小室中,同时将肝细胞培养于下层小室建立简化的肝脏器官芯片。这一简化体系可以预测大部分已知化合物的生物利用度。
其次,采用微流控体系的单向灌流,可以将多器官进行连接,并模拟药物进入血管系统,以及进入不同器官的过程。这一培养体系可以设计为平行或串联排布。但是,单向流动只能与位于下游部位的器官之间产生相互作用,因此不能模拟循环系统对上游的反馈效应。
连续灌注的器官芯片内的微流控连接更接近血液循环。这些设置基于单向流动的培养液的再循环,从而上游和下游器官之间可以相互联系。微流控连接可以通过预设的微流控通路或者灵活的单向系统而实现。重力驱动的流体有助于微流控通道连接的单个器官芯片之间的相互作用。复合器官芯片则由屏障组织(采用多孔膜进行分隔)和实质组织(位于微通道再循环相互连接的腔室中)共同组成。
将器官芯片与传感器整合,可以获得实时监测信息。例如,物理传感器可以检测细胞外微环境,电化学传感器可以检测可溶性蛋白标记物,微型显微镜可以有助于观察细胞形态变化,微流控电路板实时监测流体路径。
五、器官芯片所面临的挑战

图3:器官芯片用于药物研发
药物研发的不同阶段,器官芯片可以发挥不同的作用:药物作用机制研究,药物毒性和药效的临床前试验,病人特异性的器官芯片,罕见病治疗策略。
器官芯片具有体外模拟人体器官的潜能,但是仍存在诸多挑战,这将不断推动器官芯片设计和应用的发展。
模拟药物的吸收、分布、代谢和排泄
药物经吸收进入血液循环,然后分布至全身,进行代谢和排泄。动物模型和临床数据对于设计器官芯片系统的排布和流体方向具有指导意义。原则上,在体外可以模拟体内药物的代谢路径。静脉注射的药物进入循环系统,经过内皮屏障,然后分布到不同器官。肝脏代谢药物,并且代谢产物具有与原药不同的安全性和药效。经肝脏代谢后,药物随着血液循环到达其他脏器,发挥效应,最终经肾脏排泄。因此,体外芯片面临的挑战包括,模型中需要连续、稳定且具有功能的血管结构作为选择性屏障转运药物和活性分子,同时也需要器官之间相互作用,模拟药物研究必要的元素。药物分布是药物副作用的主要原因之一,现有模型尚不能完全模拟这一过程。
器官芯片的其他要素
未来的研究需要模型更接近人体真实情况,还应模拟免疫和内分泌系统,因为免疫系统和内分泌系统与器官的正常运转和功能存在直接联系,动物体内并不能较好模拟这一过程。现有的研究认为,微生物也是机体的重要组分,或许这也需要加入今后的器官芯片系统中。病人特异性的微生物和病人特异性的器官芯片对于模拟上述体系的相互作用也是十分重要的。此外,模型中还应考虑神经调控的作用,有助于理解神经系统疾病中不同组分的相互作用和疾病机制。



